জারণ ও বিজারণ কাকে বলে ? পার্থক্য ও অন্যান্য তথ্য
Oxidation and Reduction

জারণ ও বিজারণ কাকে বলে ? পার্থক্য ও অন্যান্য তথ্য
প্রিয় পাঠকেরা, আজকে আমরা আলোচনা করবো জারণ ও বিজারণ কাকে বলে ? জারণ ও বিজারণের পার্থক্য ও অন্যান্য তথ্য নিয়ে। Oxidation and Reduction ।
জারণ ও বিজারণ দুটি বিপরীত পক্রিয়া। জারণ ও বিজারণ পক্রিয়ায় যে দুটি পদার্থ অংশগ্রহণ করে, তাদের একটিকে জারক ও অপরটিকে বিজারক বলা হয়ে থাকে।
জারণ (Oxidation )
প্রথমে আমরা দেখে নিয়ে জারণ সম্পর্কিত বিভিন্ন তথ্য।
জারণ কাকে বলে ?
কোনো মৌল বা যৌগের সাথে অক্সিজেনের সরাসরি সংযোগকে বলা হয় জারণ।
যেমন ,
2H2 + O2 → 2H2O
2CO + O2 → 2C2O
অর্থাৎ এখানে H2 ও CO জারিত হয়ে যথাক্রমে H2O ও C2O উৎপন্ন করেছে।
পরবর্তী সময়ে এই সংজ্ঞাকে আরো ব্যাপকতর করার জন্য নতুন একটি সংজ্ঞা বার করা হয়।
দেখে নাও : ১১৮টি মৌলের পারমাণবিক সংখ্যা ও প্রতীক তালিকা
জারণ সংজ্ঞা : কোন মৌল বা যুগে অক্সিজেন বা অক্সিজেনের ন্যায় কোন তড়িৎ ঋণাত্মক মৌল বা মূলকের সংযোগ হলে বা কোন যৌগ থেকে হাইড্রোজেন বা হাইড্রোজেনের ন্যায় কোন তড়িৎ ধনাত্মক মৌল বা মূলক অপসারিত হলে সেই রাসায়নিক বিক্রিয়াকে জারণ বলা হয়।
উদাহরণ :
Cu + S → CuS
2FeCl2 + Cl2 → 2 FeCl3
জারক কাকে বলে ?
যে পদার্থের সাহায্যে জারণ ক্রিয়া সংঘটিত হয় তাকে জারক পদার্থ এবং যার জারণ ঘটে তাকে জারিত পদার্থ বা বিজারক বলা হয়।
যেমন, SnCl2 + Cl2 → SnCl4
এখানে জারক পদার্থ হল ক্লোরিন এবং এর সাহায্যে SnCl2 জারিত হয়েছে । অতএব SnCl2 এখানে বিজারক ।
বিভিন্ন ধাতু, হাইড্রোজেন, জায়মান হাইড্রোজেন ইত্যাদি জারক পদার্থ।
দেখে নাও : পর্যায় সারণির মৌলের পর্যায়বৃত্ত ধর্মসমূহ
জারণের ইলেক্ট্রনীয় মতবাদ
যে পক্রিয়ায় কোন মৌল, আয়ন বা পরমাণুপুঞ্জের (রেডিক্যাল ) তড়িৎ ধনাত্মক আধান বৃদ্ধি পায় (অর্থাৎ ইলেক্ট্রন ত্যাগ করে ) তাকে জারণ বলা হয়।
ইলেক্ট্রন আদান-প্রদানের মতবাদের মাধ্যমে এই তড়িৎ মাত্রার পরিবর্তন ব্যাখ্যা করা যায়।
ব্যাখ্যা :
ফেরাস ক্লোরাইড ক্লোরিনের সাহায্যে জারিত হয়ে ফেরিক ক্লোরাইড উৎপন্ন করে।
2FeCl2 + Cl2 → 2FeCl3
এই দ্রবণে FeCl2 বিয়োজিত হয়ে Fe++ ক্যাটায়ন ও Cl– অ্যানায়ন হিসেবে থাকে।
FeCl2 → Fe++ + 2Cl–
ফেরিক ক্লোরাইড দ্রবণে Fe3+ ক্যাটায়ন ও 2Cl– অ্যানায়ন হিসেবে থাকে। এক্ষেত্রে জারণের ফলে Fe2+ এর ধনাত্মক আধান বৃদ্ধি পেয়ে Fe3+ হয়।
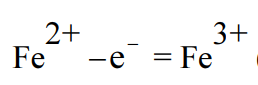
জারণ থেকে যে ধরণের প্রশ্নগুলি বিভিন্ন পরীক্ষায় এসে থাকে সেগুলি হল –
- জারণ কাকে বলে? উদাহরণসহ লিখুন।
- উদাহরণসহ জারণ বিক্রিয়ার পুরাতন ধারণা দিন।
- জারক পদার্থের সংজ্ঞা লিখুন।
- জারণ বিক্রিয়ায় ইলেকট্রনীয় মতবাদ লিখুন।
- সাধারণভাবে ব্যবহৃত এ ধরণের কিছু জারক পদার্থের উদাহরণ দিন ।
- ফেরাস আয়নের ফেরিক আয়নে পরিবর্তন একটি জারণ বিক্রিয়া। ব্যাখ্যা করুন।
বিজারণ
এবারে আমরা দেখে নেবো বিজারণ সম্পর্কিত বিভিন্ন তথ্য।
বিজারণ কাকে বলে ?
কোন মৌল বা যৌগের সাথে হাইড্রোজেনের সরাসরি সংযোগকেই প্রথম দিকে বিজারণ বলে অভিহিত করা হতো। যেমন-
Cl2 +H2 → 2HCl
N2 + 3H2 → 2NH3
পরে এই সংজ্ঞাকে আরও ব্যাপকতর করা হয়।
বিজারণ সংজ্ঞা : কোন মৌল বা যৌগে হাইড্রোজেন বা হাইড্রোজেনের ন্যায় কোন তড়িৎ ধনাত্নক মৌল বা মূলকের সংযোগ কিংবা কোন যৌগ থেকে অক্সিজেন বা অক্সিজেনের ন্যায় কোন তড়িৎ-ঋণাত্নক মৌল বা মূলকের অপসারণকে বিজারণ বলা হয়। যেমন –
HgCl2 +Hg → Hg2Cl2
ZnO + C → Zn + CO
যে পদার্থের সাহায্যে বিজারণ ক্রিয়া সংঘটিত হয় তাকে বিজারক পদার্থ এবং যার বিজারণ ঘটে তাকে বিজারিত পদার্থ বলা হয়। যেমন
ZnO + C → Zn + CO
এই রাসায়নিক বিক্রিয়ায় বিজারক পদার্থ C এর সাহায্যে ZnO বিজারিত হয়ে Zn ধাতুতে পরিণত হয়েছে।
বিজারণের ইলেক্ট্রনীয় মতবাদ
যে পক্রিয়ায় কোন পরমাণু, আয়ন বা পরমাণুপুঞ্জ এক বা একাধিক ইলেকট্রন গ্রহণের মাধ্যমে তড়িৎ-ঋণাত্মক
আধান বৃদ্ধি বা তড়িৎ-ধনাত্মক আধান হ্রাস পায় সেই প্রক্রিয়াকে বিজারণ বলা হয় ।
ব্যাখ্যা :
ফেরাস ক্লোরাইড ক্লোরিনের সাহায্যে জারিত হয়ে ফেরিক ক্লোরাইড উৎপন্ন করে।
2FeCl2 + Cl2 → 2FeCl3
এই দ্রবণে FeCl2 বিয়োজিত হয়ে Fe++ ক্যাটায়ন ও Cl– অ্যানায়ন হিসেবে থাকে।
FeCl2 → Fe++ + 2Cl–
ফেরিক ক্লোরাইড দ্রবণে Fe3+ ক্যাটায়ন ও 2Cl– অ্যানায়ন হিসেবে থাকে। এক্ষেত্রে জারণের ফলে Fe2+ এর ধনাত্মক আধান বৃদ্ধি পেয়ে Fe3+ হয়। অপরদিকে এই বিক্রিয়ায় অপসারিত ইলেক্ট্রনটি ক্লোরিন গ্রহণ করে এবং ক্লোরাইড আয়নে (CI¯) পরিণত হয়।
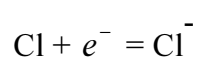
এই প্রক্রিয়ায় ক্লোরিনের তড়িৎ- ঋণাত্মক আধান বৃদ্ধি পায়। অর্থাৎ এর বিজারণ ঘটে।
বিজারক কাকে বলে ?
কোন পদার্থকে বিজারিত হতে হলে তাকে অবশ্যই ইলেকট্রন গ্রহণ করতে হবে এবং এই গৃহীত ইলেকট্রন অবশ্যই কোন পদার্থ থেকে আসতে হবে। যে সকল পদার্থ ইলেকট্রন প্রদান করতে পারে তাদেরকে বিজারক পদার্থ বলা হয়।
স্টেনাস ক্লোরাইড, ফেরাস সালফেট, লিথিয়াম অ্যালুমিনিয়াম হাইড্রাইড (LiAlH4), সোডিয়াম বোরন হাইড্রাইড (NaBH4), সোডিয়াম থায়োসালফেট প্রভৃতি যৌগগুলো বিজারক হিসেবে ব্যবহৃত হয়।
বিজারণ থেকে যে ধরণের প্রশ্নগুলি বিভিন্ন পরীক্ষায় এসে থাকে সেগুলি হল –
- উদাহরণসহ বিজারণ বিক্রিয়ার সংজ্ঞা লিখুন।
- উদাহরণসহ বিজারণ বিক্রিয়ার পুরাতন ধারণা দিন।
- বিজারক কাকে বলে? সাধারণত ব্যবহৃত হয়, এ ধরণের কিছু বিজারক পদার্থের উদাহরণ দিন।
- জারণ-বিজারণ একটি যুগপত বিক্রিয়া। ব্যাখ্যা করুন।
জারণ ও বিজারণের পার্থক্য
জারণ ও বিজারণ বিক্রিয়ার মধ্যে পার্থক্য নিম্নরূপঃ
| জারণ | বিজারণ |
|---|---|
| জারন বিক্রিয়ায় ইলেকট্রন ত্যাগ ঘটে | বিজারণ বিক্রিয়ায় ইলেকট্রন গ্রহণ ঘটে |
| জারণ বিক্রিয়ায় বিজারক সমূহ জারিত হয় | বিজারণ বিক্রিয়ায় জারক বিজারিত হয় |
| জারণ বিক্রিয়ায় অক্সিজেন বা তড়িৎ ঋনাত্মক মৌলের সংযোগ হয়। | বিজারণ বিক্রিয়ায় অক্সিজেন বা তড়িৎ ঋনাত্মক মৌলের অপসারণ হয়। |
| জারণ বিক্রিয়ায় হাইড্রোজেন বা তড়িৎ ধণাত্মক মৌলের অপসারণ হয় | বিজারণ বিক্রিয়ায় হাইড্রোজেন বা তড়িৎ ধণাত্মক মৌলের সংযোগ হয়। |
| জারণ বিক্রিয়ায় জারণ সংখ্যার বৃদ্ধি ঘটে। | বিজারণ বিক্রিয়ায় জারণ সংখ্যার হ্রাস ঘটে। |
To check our latest Posts - Click Here